疾病指標成分を特異的かつ高感度に検出し、早期診断に応用する!
病気の早期診断・早期治療に貢献できるようなバイオテクノロジーの確立を目指しています。まず、抗体のような分子認識能を持ち標的分子に特異的に結合できる特殊なDNAを開発し、病気の診断や病原性微生物の検出に応用することを目指しています。ターゲットは、エイズの進行度を測るための指標となる免疫細胞表面のタンパク質や、院内感染を引き起こす黄色ブドウ球菌などです。
また、病気を見つけ出す抗体を多数貼り付けたガラス基板(抗体チップ)を作製し、病気の指標成分を検出することにもチャレンジしています。このときにナノテクノロジーを駆使して極めて薄い膜をあらかじめガラス基板に作製しておくことで、目的の成分を高感度に検出することが可能となります。
1. 分子認識核酸(アプタマー)の診断への応用
アプタマーとは?
アプタマーとは特徴的な立体構造を形成することで、分子認識能を持つ一本鎖核酸のことです。つまり、アプタマーは抗体のように標的分子に特異的に結合することができます。そこで本研究室では疾病指標成分を検出可能なアプタマーを開発し、早期診断への応用を試みています(図1)。
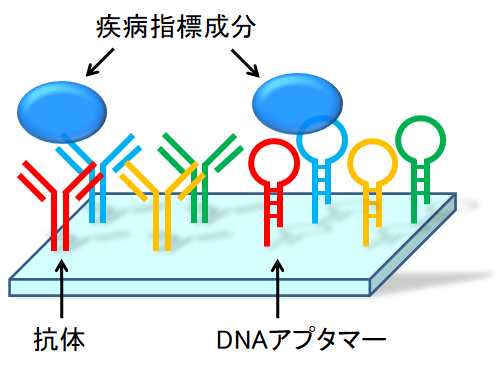
図1 DNAアプタマーによる疾病指標成分の検出
では、抗体ではなくアプタマーを分子認識素子とする利点にはどのようなものがあるでしょうか?
例えば・・・
- 抗体や酵素に比べて安定性に優れており、失活しにくい
- 単純な加熱と冷却により立体構造が復元するため、繰り返しの使用が可能である
- 全自動核酸合成装置により人工的に合成できるため、安価である
- PCRにより容易に増幅できる
- 抗体の存在しない分子に対してもアプタマーを獲得することができる
といったような利点が挙げられます。
診断ツールへの応用
私たちの研究室ではこのようなアプタマーの利点を生かして、後天性免疫不全症候群(acquired immunodeficiency syndrome:AIDS)の診断ツールの開発を行っています。AIDsはヒト免疫不全ウイルス(human immunodeficiency virus:HIV)の感染により発症する病態のことであり、様々な日和見感染症を生じることで、生命に危機をもたらします。このため、20世紀まではAIDSは「死の病」と恐れられていました。現在では、薬によりAIDSの発症や進行をコントロールすることができるようになりつつあり、適切なタイミングで適切な治療を施すために、HIV感染後の病期の進行を見極めることがより一層大切になってきています。
そこで私たちの研究室では、この病期の指標となる「CD4」を検出可能なアプタマーの開発を行っています。CD4はリンパ球の1つであるヘルパーT細胞(CD4陽性T細胞)の細胞表面上に発現する膜タンパク質です。本来、CD4は免疫反応に重要な役割を果たすのですが、HIVはこのCD4を受容体として利用してT細胞内に侵入し、感染・増幅して細胞を破壊します。このようにCD4陽性T細胞数はHIV感染後の病期の進行に伴い減少するため、CD4をアプタマーで迅速かつ簡便に検出できれば病期の診断ツールに応用することができると考えています。
上記の研究の他にも、アプタマーを利用することで、黄色ブドウ球菌や緑膿菌といった病原性微生物を迅速に検出する方法の開発に取り組んでいます。また、がんや神経変性疾患などの病態と関連が深い「ユビキチン」というタンパク質を認識するアプタマーの獲得を試みています。
2. 高感度な疾病指標成分検出システムの開発
私たちの研究室では疾病指標成分の高感度検出システムの開発を目指しています。医療の分野において疾病の早期診断・早期治療は健康への鍵と言えます。そこで本研究室では微量な疾病指標成分を検出可能な高感度システムを開発し、早期診断への応用を目指しています。具体的には、基板表面に特殊なナノ薄膜をコーティングすることで、検出感度の向上をはかっています。例えば、診断に用いる抗体アレイでは、様々な疾病指標成分を認識する抗体をスライドガラスなどの基板上に固定化することが知られています。私たちの研究室では、このような基板表面を特殊なナノ薄膜でコーティングすることで、検出感度の向上をはかっています(図2)。
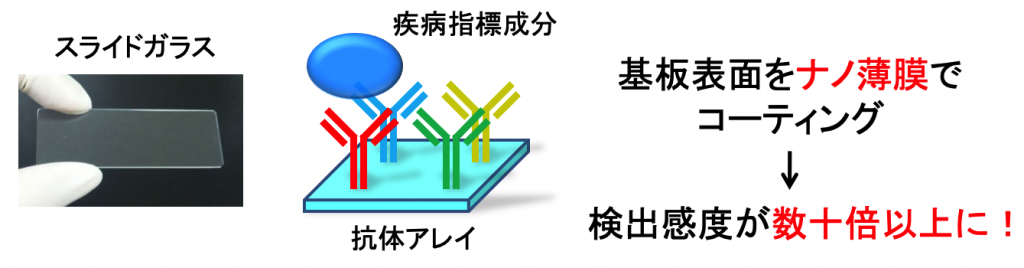
図2 ナノ薄膜のコーティングによる疾病指標成分の高感度検出
疾病指標成分を発見して治療や診断に応用する!
